티스토리 뷰
Piper 도표 문제 해설 - 시험 대비 핵심 정리
안녕, 시험 준비생! 이번에 풀어볼 문제는 Piper 도표에 관한 거야. Piper 도표는 지하수 화학을 분석하고 분류하는 데 중요한 도구라 시험에 자주 나와. 선택지를 하나씩 보면서 뭐가 틀렸는지 찾아보고, 외우기 쉽게 비유랑 팁도 줄게. 이 해설로 Piper 도표 완벽히 잡고 시험 점수 올리자!
문제: Piper 도표에 대한 설명으로 가장 옳지 않은 것은?
- 화학적 조성에 따라 지하수 등을 분류하는 도표이다.
- 주요 분류 이온으로 Na⁺, Ca²⁺, Cl⁻, Fe²⁺, HCO₃⁻, SO₄²⁻, Mg²⁺, CO₃²⁻ 등이 있다.
- 지하수가 대수층을 통과하여 흐르는 동안 주변 암석과의 반응에 의하여 고유의 화학성분을 형성한다고 가정한다.
- 분석 결과는 각 양이온과 음이온의 함량에 따라서 표시된다.
1. Piper 도표란? 간단 정리
Piper 도표를 모르면 문제를 못 풀어! 먼저 기본 개념부터 잡자:
- 정의: 지하수의 화학적 조성을 보고 분류하는 그래프야.
- 구성: 양이온 삼각형(Na⁺, Ca²⁺, Mg²⁺) + 음이온 삼각형(Cl⁻, HCO₃⁻, SO₄²⁻) + 가운데 다이아몬드.
- 비유: "지하수의 DNA 검사" - 이온 비율로 물의 정체를 파악!
팁: "Piper = 삼각형 2개 + 다이아몬드"로 기억해!
2. 선택지 분석 - 옳고 그름 체크!
1번: 화학적 조성에 따라 지하수 등을 분류하는 도표이다.
- 설명: Piper 도표는 지하수의 이온 조성을 분석해서 Ca-HCO₃형, Na-Cl형처럼 분류해.
- 비유: "물의 혈액형을 알아내는 도구."
- 판단: Piper 도표의 핵심 기능이라 맞아! → O
2번: 주요 분류 이온으로 Na⁺, Ca²⁺, Cl⁻, Fe²⁺, HCO₃⁻, SO₄²⁻, Mg²⁺, CO₃²⁻ 등이 있다.
- 설명: Piper 도표는 6대 주요 이온(Na⁺, Ca²⁺, Mg²⁺, Cl⁻, HCO₃⁻, SO₄²⁻)으로 분류해.
- 문제: Fe²⁺는 주요 이온 아님! 지하수에 흔치 않고, CO₃²⁻도 pH 높을 때만 조금 나와.
- 비유: "주연 배우는 6명인데, Fe²⁺는 엑스트라야."
- 판단: Fe²⁺를 주요 이온으로 넣은 건 틀렸어 → X
암기 팁: "Piper 이온 = Na, Ca, Mg, Cl, HCO₃, SO₄" 6개만 외워! Fe²⁺는 함정!"
3번: 지하수가 대수층을 통과하여 흐르는 동안 주변 암석과의 반응에 의하여 고유의 화학성분을 형성한다고 가정한다.
- 설명: 지하수가 암석(석회석, 염류 등)을 녹이거나 반응하며 고유 이온을 가짐. Piper 도표는 이걸 분석.
- 비유: "지하수가 암석 여행하며 맛을 바꿈."
- 판단: Piper 도표의 기본 원리라 맞아! → O
4번: 분석 결과는 각 양이온과 음이온의 함량에 따라서 표시된다.
- 설명: Piper 도표는 이온 함량(%)을 삼각형과 다이아몬드에 점으로 찍어 보여줌.
- 비유: "이온 농도를 지도에 좌표 찍듯 표시."
- 판단: Piper 도표의 작도 방식이라 맞아! → O
3. 정답은 뭐야?
선택지 정리:
- 1번(O): 지하수 분류 → 맞음.
- 2번(X): Fe²⁺가 주요 이온 아님 → 틀림.
- 3번(O): 암석 반응 → 맞음.
- 4번(O): 이온 함량 표시 → 맞음.
가장 옳지 않은 것은 2번이야!
4. 시험 대비 핵심 팁
Piper 도표는 화학공학, 환경공학 시험 단골이야. 다음만 외우면 문제없어:
- 주요 이온: Na⁺, Ca²⁺, Mg²⁺ / Cl⁻, HCO₃⁻, SO₄²⁻ (6개만 기억! Fe²⁺는 X).
- 용도: 지하수 분류.
- 표시법: 삼각형 2개 + 다이아몬드.
시험 팁: "Fe²⁺ 나오면 의심부터 해라! Piper는 6대 이온만 사랑해!"
5. 마무리
이제 Piper 도표 문제 확실히 잡았지? 2번의 Fe²⁺ 함정만 조심하면 돼. 시험에서 자신 있게 풀고, 합격으로 한 발짝 더! 화이팅하고, 더 궁금한 거 있으면 댓글 남겨줘!
Piper 도표 완벽 정리 - 그림과 함께 배우기
안녕, 시험 준비생! Piper 도표에 대해 더 깊이 알아보고 싶다고 했지? Piper 도표는 지하수 화학을 분석하고 분류하는 데 필수적인 도구야. 이번 글에서는 Piper 도표의 구조, 작도 방법, 활용 사례를 자세히 설명하고, 그림도 추가해서 쉽게 이해할 수 있게 도와줄게. 시험 대비용으로 핵심만 쏙쏙 외우자!
1. Piper 도표란?
Piper 도표는 지하수의 화학적 성분을 시각적으로 보여주는 그래프야. 시험에서 자주 나오는 만큼 개념을 확실히 잡아놓자.
- 정의: 지하수의 주요 이온 조성에 따라 분류하는 도표.
- 목적: 물의 화학적 특성을 파악해 출처나 성질을 알아냄 (예: Ca-HCO₃형, Na-Cl형).
- 비유: "지하수의 혈액형 검사" - 이온 비율로 DNA처럼 정체를 밝힘.
2. Piper 도표의 구조와 그림
Piper 도표는 독특한 모양으로 돼 있어. 아래에 구조를 설명하고, 그림도 확인해 보자.
- 구성:
- 양이온 삼각형: Na⁺ + K⁺, Ca²⁺, Mg²⁺ (왼쪽 아래).
- 음이온 삼각형: Cl⁻, HCO₃⁻, SO₄²⁻ (오른쪽 아래).
- 다이아몬드: 양이온+음이온 합친 결과 (가운데).
- 특징: 각 이온의 상대 비율(%)을 점으로 표시.
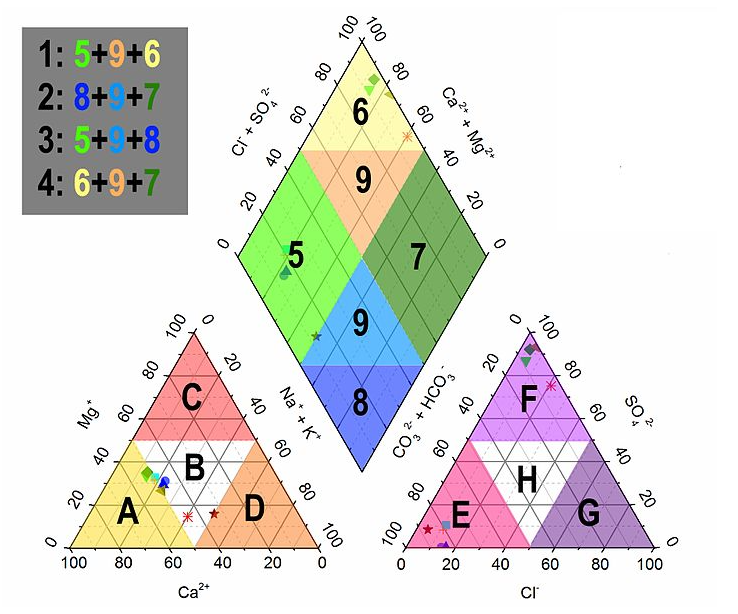
이미지 설명: 왼쪽 아래에 양이온 삼각형(Na⁺+K⁺, Ca²⁺, Mg²⁺), 오른쪽 아래에 음이온 삼각형(Cl⁻, HCO₃⁻, SO₄²⁻), 가운데에 다이아몬드 영역이 있는 그래프. 점들이 각 영역에 찍혀 있음.
팁: "Piper = 삼각형 2개(양, 음) + 다이아몬드"로 외워! 그림 보면 바로 이해돼."
3. 주요 이온 - 뭐로 분류하나?
Piper 도표는 특정 이온으로 지하수를 분석해. 시험에서 이 부분이 자주 나와!
- 주요 이온:
- 양이온: Na⁺, Ca²⁺, Mg²⁺ (K⁺는 Na⁺와 합쳐짐).
- 음이온: Cl⁻, HCO₃⁻, SO₄²⁻.
- 주의: Fe²⁺, CO₃²⁻는 주요 이온 아님! 미량이거나 조건에 따라 나옴.
- 비유: "6대 주연 배우만 기억해! Fe²⁺는 엑스트라."
암기 팁: "Na, Ca, Mg / Cl, HCO₃, SO₄" 6개만 외우면 돼!"
4. 작도 방법 - 어떻게 그리나?
Piper 도표를 어떻게 만드는지 알면 시험 문제 이해가 쉬워져.
- 단계:
- 지하수 샘플의 이온 농도 분석 (mg/L).
- 각 이온을 meq/L(밀리당량/리터)로 변환.
- 총 양이온과 음이온의 백분율(%) 계산.
- 양이온 삼각형, 음이온 삼각형에 점 찍기.
- 두 점을 다이아몬드에 투영해서 최종 위치 확인.
- 비유: "이온 농도를 좌표로 바꿔 별자리 그리기."
예시: Ca²⁺ 40%, Mg²⁺ 30%, Na⁺ 30% / HCO₃⁻ 60%, SO₄²⁻ 30%, Cl⁻ 10% → 삼각형에 점 찍고 다이아몬드로 합침.
5. 활용 사례 - 어디에 쓰이나?
Piper 도표가 실무와 시험에서 왜 중요한지 알아보자:
- 지하수 유형 분류: 예: Ca-HCO₃형(석회석 지역), Na-Cl형(염분 지역).
- 수질 변화 분석: 지하수가 암석과 반응하며 어떻게 변하는지 추적.
- 환경 조사: 오염 여부나 물의 기원 파악.
- 비유: "지하수의 여행 기록을 읽는 탐정 도구."
6. 시험 대비 핵심 포인트
시험에서 Piper 도표 문제 나오면 이 3가지만 기억해:
- 주요 이온: Na⁺, Ca²⁺, Mg²⁺ / Cl⁻, HCO₃⁻, SO₄²⁻ (6개! Fe²⁺는 X).
- 구조: 삼각형 2개 + 다이아몬드.
- 원리: 암석 반응으로 이온 형성 → 분류.
시험 팁: "Fe²⁺ 나오면 틀렸다고 써! Piper는 6대 이온만 사랑해!"
7. 마무리
이제 Piper 도표의 모든 것(구조, 이온, 작도, 활용)을 그림과 함께 이해했지? 시험에서 Piper 도표 문제 나오면 겁먹지 말고 자신 있게 풀어! 공부 열심히 한 너라면 충분히 할 수 있어. 화이팅하고, 질문 있으면 댓글로 물어봐!
Piper 도표 작도 방법 - 시험 대비 단계별 정리
안녕, 시험 준비생! Piper 도표 작도 방법이 궁금하다고 했지? Piper 도표는 지하수 화학 분석 결과를 그래프로 그리는 거야. 시험에서 "작도 과정"이나 "분석법" 문제가 나오면 이걸 알면 쉽게 풀 수 있어. 단계별로 설명하고, 비유랑 팁으로 외우기 쉽게 도와줄게!
1. Piper 도표란?
작도 방법을 알기 전에 Piper 도표가 뭔지 간단히 복습:
- 정의: 지하수의 주요 이온 비율로 분류하는 그래프.
- 구조: 양이온 삼각형(Na⁺, Ca²⁺, Mg²⁺) + 음이온 삼각형(Cl⁻, HCO₃⁻, SO₄²⁻) + 다이아몬드.
- 비유: "지하수의 화학 지도" - 이온 함량을 점으로 표시.
2. Piper 도표 작도 단계
Piper 도표는 지하수 샘플의 이온 데이터를 그래프에 그리는 과정이야. 5단계로 나눠서 자세히 보자!
- 이온 농도 분석 (mg/L)
- 지하수 샘플에서 주요 이온(Na⁺, Ca²⁺, Mg²⁺, Cl⁻, HCO₃⁻, SO₄²⁻) 농도를 측정.
- 비유: "지하수의 재료 목록 작성."
- meq/L로 변환 (밀리당량/리터)
- mg/L를 meq/L로 바꿈: \( \text{meq/L} = \frac{\text{mg/L}}{\text{당량 질량}} \).
- 당량 질량 = 분자량 ÷ 전하 수 (예: Ca²⁺는 40 ÷ 2 = 20).
- 비유: "재료 무게를 공통 단위로 맞춤."
- 백분율(%) 계산
- 총 양이온과 총 음이온의 meq/L 합을 구하고, 각 이온의 비율(%) 계산.
- 예: 총 양이온 10 meq/L, Ca²⁺ 4 meq/L → Ca²⁺ = 40%.
- 비유: "각 재료가 전체에서 몇 %인지 나누기."
- 삼각형에 점 찍기
- 양이온 삼각형에 Na⁺, Ca²⁺, Mg²⁺ 비율 점 찍기.
- 음이온 삼각형에 Cl⁻, HCO₃⁻, SO₄²⁻ 비율 점 찍기.
- 비유: "삼각형 캔버스에 이온 별자리 그리기."
- 다이아몬드에 투영
- 두 삼각형의 점을 가운데 다이아몬드 영역에 합쳐 최종 위치 표시.
- 비유: "양쪽 별자리를 합쳐 지하수의 최종 좌표 찾기."
암기 팁: "분석 → 변환 → 백분율 → 삼각형 → 다이아몬드" 5단계로 외워!"
3. 작도 예시 - 실제로 해보자!
숫자로 보면 이해가 쉬워. 간단한 예시를 보자:
샘플 데이터 (mg/L):
- Na⁺: 23, Ca²⁺: 40, Mg²⁺: 12.
- Cl⁻: 35, HCO₃⁻: 122, SO₄²⁻: 48.
1. meq/L 변환:
- Na⁺: 23 ÷ 23 = 1 meq/L.
- Ca²⁺: 40 ÷ 20 = 2 meq/L.
- Mg²⁺: 12 ÷ 12 = 1 meq/L.
- Cl⁻: 35 ÷ 35 = 1 meq/L.
- HCO₃⁻: 122 ÷ 61 = 2 meq/L.
- SO₄²⁻: 48 ÷ 48 = 1 meq/L.
2. 백분율 계산:
- 총 양이온: 1 + 2 + 1 = 4 meq/L → Na⁺ 25%, Ca²⁺ 50%, Mg²⁺ 25%.
- 총 음이온: 1 + 2 + 1 = 4 meq/L → Cl⁻ 25%, HCO₃⁻ 50%, SO₄²⁻ 25%.
3. 점 찍기: 양이온 삼각형(25, 50, 25), 음이온 삼각형(25, 50, 25) → 다이아몬드에 투영.
이 데이터는 Ca-HCO₃형 지하수로 분류돼!
4. Piper 도표 그림

이미지 설명: 왼쪽 아래 양이온 삼각형(Na⁺+K⁺, Ca²⁺, Mg²⁺), 오른쪽 아래 음이온 삼각형(Cl⁻, HCO₃⁻, SO₄²⁻), 가운데 다이아몬드. 예시 점이 각 영역에 찍혀 있음.
티스토리 편집기에서 '이미지 추가'로 Piper Diagram 샘플 업로드!
5. 시험 대비 핵심 포인트
시험에서 Piper 도표 작도 묻으면 이렇게 기억해:
- 단계: mg/L → meq/L → % → 삼각형 → 다이아몬드.
- 주요 이온: Na⁺, Ca²⁺, Mg²⁺ / Cl⁻, HCO₃⁻, SO₄²⁻.
- 목적: 지하수 화학 분류.
시험 팁: "5단계 + 6대 이온"만 외우면 작도 문제 OK!"
6. 마무리
이제 Piper 도표 작도 방식 확실히 알았지? 단계별로 따라가면 어렵지 않아. 시험에서 "작도 순서"나 "분석법" 나오면 침착하게 풀고, 좋은 점수 받자! 화이팅하고, 더 궁금한 거 있으면 댓글로 물어봐!
'서울시 환경공학 기출' 카테고리의 다른 글
| 2024 서울시 환경공학 7번 (0) | 2025.05.02 |
|---|---|
| 알칼리도 (0) | 2025.04.19 |
| 24년 서울시 환경공학 5번 (0) | 2025.03.15 |
| 24년 서울시 환경공학 3번 (0) | 2025.03.15 |
| 24년도 서울시 환경공학 1번 (0) | 2025.03.15 |
